治験依頼者の方へ
For Client
KOBE Univ. Hosp. CTRC for Client
治験における各種手続き・様式集
治験新規手続きの流れ
例)10月IRBへ申請する場合
9 月
| SUN | MON | TUE | WED | THU | FRY | SAT |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | ||||
| 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 18 | 19 | 20 | 21 | 22 | 23 | 24 |
| 25 | 26 | 27 | 28 | 29 | 30 |
経費関連書類の作成
仮申請〆切
ヒアリング
依頼者と医師の間での合意
分担医師を記載した書式2を提出
(IRB6週間前)
仮申請〆切
(IRB4週間前)
必要な資料を提出
・申請資料(仮)
・審議資料(2部)
・経費、契約関連資料(仮)
・利益相反マネジメント自己申告書
ヒアリング
10 月
| SUN | MON | TUE | WED | THU | FRY | SAT |
|---|---|---|---|---|---|---|
| 1 | ||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 23 | 24 | 25 | 26 | 27 | 28 | 29 |
| 30 | 31 |
本申請〆切
IRB
指示決定通知書の送付
契約書の送付
本申請〆切
(IRB2週間前)
必要な資料を提出
・申請資料
・審議資料(20部)
・経費、契約関連資料
・審議資料の電子版
IRB
指示決定通知書の送付
契約書の送付
11 月
| SUN | MON | TUE | WED | THU | FRY | SAT |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | ||
| 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 20 | 21 | 22 | 23 | 24 | 25 | 26 |
| 27 | 28 | 29 | 30 |
契約の締結(審査結果による)
スタートアップミーティング・治験薬搬入
契約の締結(審査結果により前後します)
スタートアップミーティング
・申請資料
・治験薬搬入
治験開始
- IRB当日は治験責任または分担医師より治験の概要について出席説明をお願いします。
- IRB約一週間前、責任医師宛に出席説明について案内メールを送信します。
- 出席説明される医師には、約5分前にご連絡いたします。
治験薬搬入ならびにスタートアップミーティングについて
治験薬搬入は契約締結以降です。
治験薬と共に、以下のものもご用意ください。
1. 治験薬取り扱い手順書
2. 治験薬管理表
3. 治験薬サマリー
4. 被験者への服薬説明書(必要時)
5. 外注用検査資材
6. 患者提供物品など
治験薬サマリー作成時の注意点
本サマリーは治験薬調剤を正確かつ迅速に行うため使用します。
*以外をご記入ください。(詳細は治験薬サマリー作成時の留意事項のシートをご確認ください)
1. 治験責任、CRC:治験を担当の氏名を記入
2. 用法・用量:簡潔に記入
3. 併用禁止・可能・注意薬、同種同効薬リスト:一般名と商品名(主なもの)を記載
4. 被験者への服薬説明書(必要時)
5. 治験スケジュール表:投薬・診察・検査日程・検査項目等を記載
6. 副作用:頻度の高いものについては、発生頻度も記載。その他、主な副作用、重篤な副作用について記載
新規申請に必要な書類
厚生労働省:治験の依頼等に係る統一書式よりダウンロード申請書類について
- ① 臨床研究に係る利益相反マネジメント自己申告書
-
② 責任医師の履歴書(書式1)
-
③ 治験分担医師・治験協力者リスト(書式2)
-
④ 治験依頼書(書式3)
- ⑤ 同意説明文書
-
⑥ 事務上の確認事項
- ⑦ 治験概要
- ⑧ 説明補助資料・・・21部
① 臨床研究に係る利益相反マネジメント自己申告書について
1研究者につき1部作成(IRB事務局にて対応します)*自署・押印
臨床研究に係る利益相反マネジメント自己申告書
② 責任医師、③ 分担医師の規定について
| 区分 | 資格 | 厚生労働省への届 契約書記載 |
同意・診察・処方・検査オーダー・症例報告書 |
|---|---|---|---|
| 責任医師 | 助教・講師・准教授・教授※ | あり | ○ |
| 分担医師 | 医員以上の医師、診療従事許可を持つ大学院生 | あり | ○ |
- 履歴書の治験等実績記載欄について…実施件数等は空欄とし、備考欄に「実績は別紙参照」と記載ください。別紙は当センターが作成し、依頼者保管分は指示決定通知書と併せて送付します。
- 分担医師の履歴書は提出不要です。
③の電子ファイルを分担医師決定後、速やかにchiken*med.kobe-u.ac.jpへ提出してください。(*を@に変えてください)
※提出締切:IRB6週間前
④ 治験依頼書(書式3)の添付資料一覧について
作成年月日と版数の記載が不要の資料名(履歴書など)については作成年月日と版数の欄を削除していただいても結構です。作成年月日と版数の欄を残す場合は空欄の版数記載欄に「なし」と記載してください。
④~⑥の電子ファイルを仮申請締切前にchiken*med.kobe-u.ac.jpへ提出してください。(*を@に変えてください)
件名:「 月IRB(治験短縮名) 新規申請データ】/ 依頼者様名 担当者様名 」
※電子ファイルの名称例
③ 治験短縮名_書式2_月IRB新規.doc(例)
④ 治験短縮名_書式3_月IRB新規.doc(例)
⑤ 治験短縮名_治験概要_月IRB新規.doc(例)
⑥ 治験短縮名_事務上の確認事項_月IRB新規.xls
⑦説明補助資料について
IRB委員へ補助資料として配布します。出席説明される責任/分担医師と相談のうえ、本申請時(IRB2週間前)に審議ファイルと併せて提出してください。
- 疾患について(疫学、現在の標準治療 など)
- 治験薬について(作用機序、開発の経緯 など)
- これまでの試験成績の概要(有効性・安全性)
- 治験の要約(目的、対象、デザイン、開発相 など)
- 選択・除外基準
- 評価項目
- 症例数の設定根拠
- スケジュール
- 検査・観察項目
- 併用禁止・制限薬
- 遺伝子解析を伴う場合は、その内容
- その他必要な項目
※パワーポイント20スライド程度,A4両面2スライド,ページ番号記載
統一書式導入について
2008年9月IRB申請分より、当院でも治験・製造販売後臨床試験において統一書式の運用を開始しました。
※別紙1 統一書式役割分担表
※書式/記載上の注意点:厚生労働省 統一書式
- 「統一書式に関する記載上の注意事項」に従って記載してください。
- 【企業治験・製造販売後臨床試験用】をご使用ください。
- 当院独自の追加注意事項は、各種申請のページに記載しております。
経費・契約関連の書類について
2017年11月以降、事務局業務の一部をシミックヘルスケア・インスティテュート株式会社が行っております。
新規に申請される依頼者様は、必要書類を当センター契約担当者までお問い合わせください。
Email:k9ccr*med.kobe-u.ac.jp(*を@に変えてください)
件名:【お問い合わせ】 (←主なお問い合わせ内容をご記載下さい)について
なお、算定基準については『神戸大学医学部附属病院治験等経費算定要領』をご確認ください。
審議資料について
○ 仮締切(IRB4週間前)まで…仮確定のファイルを2部提出
○ 本締切(IRB2週間前)まで…最終確定のファイルを20部提出
☆ 電子資料についてもメールまたはCD-Rにてご提供ください
※同じ治験を2科以上でご申請の場合、審議資料が同じであれば申請ファイルは1科分で結構です。詳しくはIRB事務局までお問い合わせください。
ファイル内訳
- ① 合意書(写)
- ② 治験実施計画書
- ③ 症例報告書見本
- ④ 治験薬概要書
- ⑤ 同意説明文書
- 【ICF共通テンプレート】 【同意説明文書別冊見本】 【妊娠に関する同意説明文書(推奨)】
- ⑥ 治験責任医師の履歴書(書式1)及び治験分担医師・治験協力者リスト(書式2)
- ⑦ 被験者の健康被害に対する補償に関する資料
- ⑧ 経費算定書及びポイント算出表等
- ⑨ 治験の費用に関する事項を記載した文書(被験者への支払に関する資料(支払がある場合))
- ⑩ 被験者の募集手順(広告等)に関する資料(*ある場合)
- ⑪ 被験者の安全に係わる報告(*必要時)
- ⑫ 同種同効薬(治験依頼者負担薬)・併用禁止薬に関する資料
- 【併用禁止薬リスト見本】 【併用可能な同種同効薬リスト見本】 【併用制限薬リスト見本】
- ⑬ 開発業務受託機関(CRO)の業務範囲に関する資料(※必要時)
- ⑭ 治験審査委員会が必要と認める資料(※必要時)
- 【治験参加カードの作成について(見本あり)】
注意点
- ① 治験責任医師と治験依頼者が合意したもの
- ② 治験責任医師と治験依頼者が合意したもの
- ③ 研究実施計画書から読み取れる場合は不要
- ④ 製造販売後臨床試験は添付文書とインタビューフォームを提出
- ⑤ カラー版を提出
患者様へ提供する「健康被害に対する補償の概要」も必ず提出 - ⑥ 治験分担医師・治験協力者リスト(書式2)
- IRB6週間前までに協力者以外を記載
- 電子ファイルを当センターへ提出
- 当センターで最新の協力者を記入
- ⑦ 保険の概要
- ⑧ 内容について臨床研究推進センター契約担当者に確認の上挿入
- 経費算定書・各種ポイント算出表
- 診療費用負担区分内訳書(入院費用を依頼者が負担する場合)
- ⑩ ポスター、ホームページ用原稿など(ホームページ用原稿は「現在募集中の治験」を参考に作成し、内容について責任医師の了承を得てください)
- ⑫
- 一般名と商品名(先発品のみでよい)を併記
- 同種同効薬は併用可能薬と併用禁止薬に分けて記載
- 該当する併用可能な同種同効薬が無い場合でも「なし」と記載された書類を提出
資料のファイリング
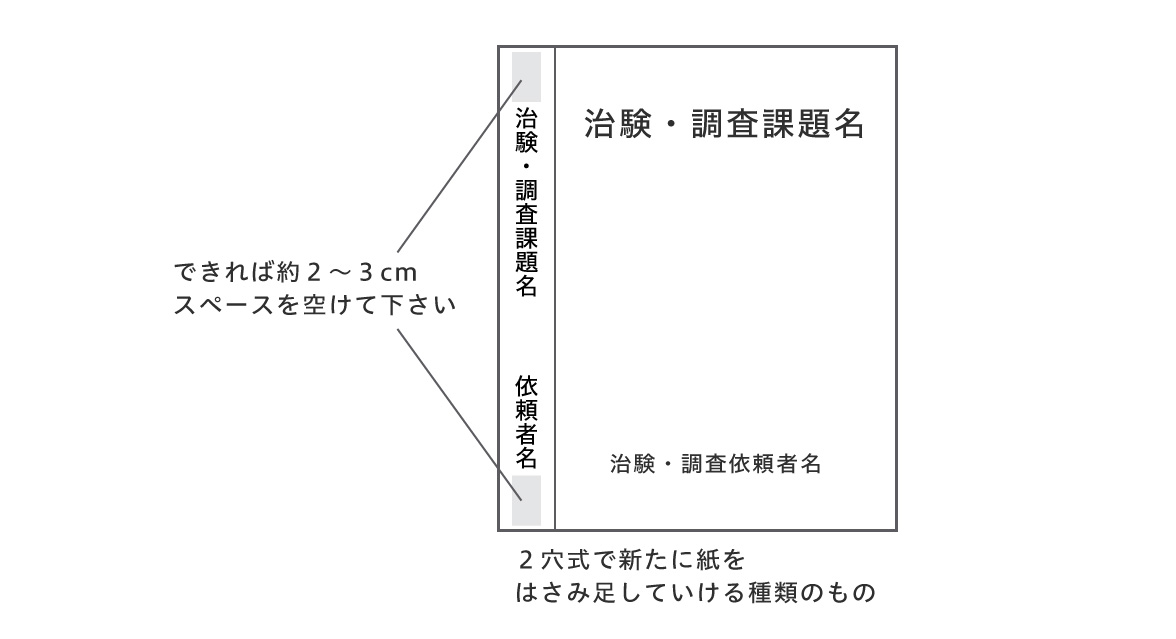
内訳ごとにインデックスを付け、資料をファイリングしてください。
治験変更手続き
変更申請に必要な書類
申請書類について
- ① 治験に関する変更申請書(書式10)
【書式見本・記入上の注意】 - (② 履歴書)書式1
① 変更申請について
- 変更事項が2件以上ある場合、変更申請書は1枚にまとめて作成してください。
- 規定される投与及び観察が終了した場合は必須としませんが、変更申請を終了する旨を記載したレターを提出してください。
② 履歴書について
-
責任医師の変更がある場合は提出してください。
※「分担医師⇒責任医師になる場合」も提出が必要です。
実績:空欄、備考欄に「実績は別紙参照」と記載してください。
分担医師の追加がある場合
- 履歴書の提出は不要です。
- ①の添付資料欄に「書式2(治験分担医師・治験協力者リスト)年月日付」と記載してください。
- 平成27年5月1日から分担医師を新たに追加する場合、利益相反マネジメント自己申告書の提出が必須となりました。(IRB事務局にて対応します)
経費・契約関連の書類
契約内容の変更がある場合、神戸大学契約書式7を作成し、契約担当者までご連絡ください。
Email:k9ccr*med.kobe-u.ac.jp(*を@に変えてください)
件名:【お問い合わせ】 (←主なお問い合わせ内容をご記載下さい)について
迅速審査について
迅速審査の対象
-
治験の期間が1年を超えない場合の治験契約期間の延長
※通常審査をご希望の場合はご相談ください - 治験分担医師の追加
-
治験分担医師の追加及び削除
※治験分担医師の削除のみの場合通常審査をお願いしております。
病院長報告(軽微な変更)について
病院長報告のみの対象となる変更
- 実施症例数の追加
- 治験依頼者の組織・体制の変更(代表者・住所・モニター等の依頼者組織内の変更)※
- 実施施設数の変更
- 他施設の体制の変更(責任医師・住所の変更)
- 併用禁止・制限リストの変更(商品名追加などプロトコールに変更のないもの)
- 複数年契約の場合における年度内予定症例数の変更
- 医師の職名や所属の変更(責任医師も含む)
- 保険契約付保証明書の契約期間の変更
上記以外の軽微な変更についてはご相談ください。
提出形態
- 書類の形式は問いませんが、見本参照のうえ1部提出してください。【見本】
- 変更内容を前後対比表に記載してください
治験安全性の申請手続き
安全性の申請手続きに必要な書類
申請書類について
- ① 安全性情報に関する報告書(書式16)
- ② 有害事象報告一覧表
① 安全性情報に関する報告書について
- 備考欄には責任医師の見解を必ず記載してください。
- 提供期間について
原則として、治験実施計画書で規定されている実施期間まで。
※規定される投与及び観察が終了し安全性情報の提供を終了する場合、レターの提出が必要です。
病院長・責任医師宛てに(連名で可)提供を終了する旨を記載の上、提出してください。 - 終了報告が提出済みの有害事象は審議対象外です。
② 有害事象報告一覧表について
- 製薬協の推奨ラインリスト、治験安全性最新報告概要、国内重篤副作用等症例の発現状況一覧を提出してください。
A:個別症例報告の場合 症例票は提出不要
- 国内外問わず、個別症例報告について症例票の提出は不要です。提出を希望される場合はお問い合わせください。
- 詳細な情報の提出が必要と判断された場合、症例票などの提出をお願いすることがあります。
B:1年ごとの年次報告の場合 症例票は提出不要
- 措置・研究報告がある場合、一覧表への記載は不要です。概要を提出してください。
重篤な有害事象/有害事象の報告
重篤な有害事象/有害事象の報告に必要な書類・資料
申請書類について
① 重篤な有害事象に関する報告書/有害事象に関する報告書
【医薬品治験:書式12】
【医薬品製造販売後臨床治験:書式13】
【医療機器治験:書式14】
【医療機器製造販売後臨床試験:書式15】
【再生医療等製品治験:書式19】
【再生医療等製品製造販売後臨床試験:書式20】
② 重篤な有害事象に関する報告書/有害事象に関する報告書(詳細記載用書式)
終了(中止)報告
終了(中止)報告に必要な書類・資料
申請書類について
① 治験終了(中止・中断)報告書(書式17)
・整理番号の末尾がAの試験:15日締め、翌月IRB報告です。
・整理番号の末尾がBまたは数字の試験:月末締め、翌月IRB報告です。
治験修正
修正に必要な書類
申請書類について
① 治験実施計画書等修正報告書(書式6)
資料について
指示事項にあるもの
治験・継続審査/申請
2025年度 治験・継続審査/申請
【複数年契約】【単年度契約】どちらに該当するかご確認の上、必要書類の提出をお願いします。
(原則として2月のIRBにて継続審査を行います。)
提出期限・・・2025年12月26日(金)必着
(※上記期日を過ぎる場合、IRB事務局までご相談ください)
複数年契約の場合【※継続審査が必要】
申請書類について
① 治験実施状況報告書(書式11)
治験の期間は治験実施計画書に記載された期間を記載ください。
※同時に変更申請がある場合、「経費/契約関連の書類について」をお読みください。
経費・契約関連の書類
Email:k9ccr*med.kobe-u.ac.jp(*を@に変えてください)
件名:【お問い合わせ】 (←主なお問い合わせ内容をご記載下さい)について
資料について
なし
単年度契約の場合【継続申請・継続審査が必要】
申請書類について
- ① 履歴書(書式1)
- ② 審査依頼書(書式3)
- ③ 治験実施状況報告書(書式11)
- ④ 変更対比表(自由)
- ⑤ 治験概要
- ④ 変更点がある場合、提出してください。(書式10(変更申請書)は不要)
- ⑤ 製造販売後臨床試験の場合、不要です。
経費・契約関連の書類
必要書類につきましては、契約担当者までお問い合せください。
TEL:078-382-6516
資料について
- 申請資料ファイル
- 新規ファイル作成時と同じ。
- 初回審議ファイルの最新版をご準備ください。
モニタリング(直接閲覧)
実地でのモニタリング(直接閲覧)に必要な書類
申請書類について
① 予め指名されたモニター(監査)のリスト等
※初回実施日までに提出してください。改訂された場合、その都度最新版の提供をお願いします。
② 直接閲覧実施連絡票(参考書式2)
※実施ごとに提出してください。連絡票表記の「確認欄」を用いてのご返信はしておりません。
注意事項
- 予め担当者と日程調整をされた後、申請書類をIRB事務局へご提出ください。
- 申し込み締切はモニタリング/監査の10日前です。
- モニタリング/監査の時間: 9:00~16:00(平日)
- 担当医師のインタビューがある場合、その旨お知らせください。
【モニタリング及び監査終了後】
医師主導治験の場合、モニタリング結果報告書を1ヵ月以内に提出してください。
各治験SOP等で定めるモニタリング結果報告書様式がない場合、
当院参考様式 (様式25-1(見本)、様式25-2(見本)をご利用ください。
遠隔地からのモニタリング(リモートSDV)について
- 2021年7月以降、電子カルテを遠隔地から閲覧する「リモートSDV」の運用を開始しました。ご希望される場合には「rsdv@med.kobe-u.ac.jp」までお問い合わせください。
緊急回避
緊急回避に必要な書類・資料
申請書類について
- ① 緊急の危険を回避するための治験実施計画書からの逸脱に関する報告書(書式8)
- ② 緊急の危険を回避するための治験実施計画書からの逸脱に関する通知書(書式9)
製造販売承認取得・開発中止及び治験の中止・中断
製造販売承認取得・開発中止及び治験の中止・中断時に必要な書類・資料
申請書類について
- ① 開発の中止等に関する報告書(書式18)
・整理番号の末尾がAの試験:15日締め、翌月IRB報告です。
・整理番号の末尾がBまたは数字の試験:月末締め、翌月IRB報告です。
経費・契約関連の書類
なし
資料について
なし