研究者の方へ
For Researcher
KOBE Univ. Hosp. CTRC for Researcher
倫理審査について
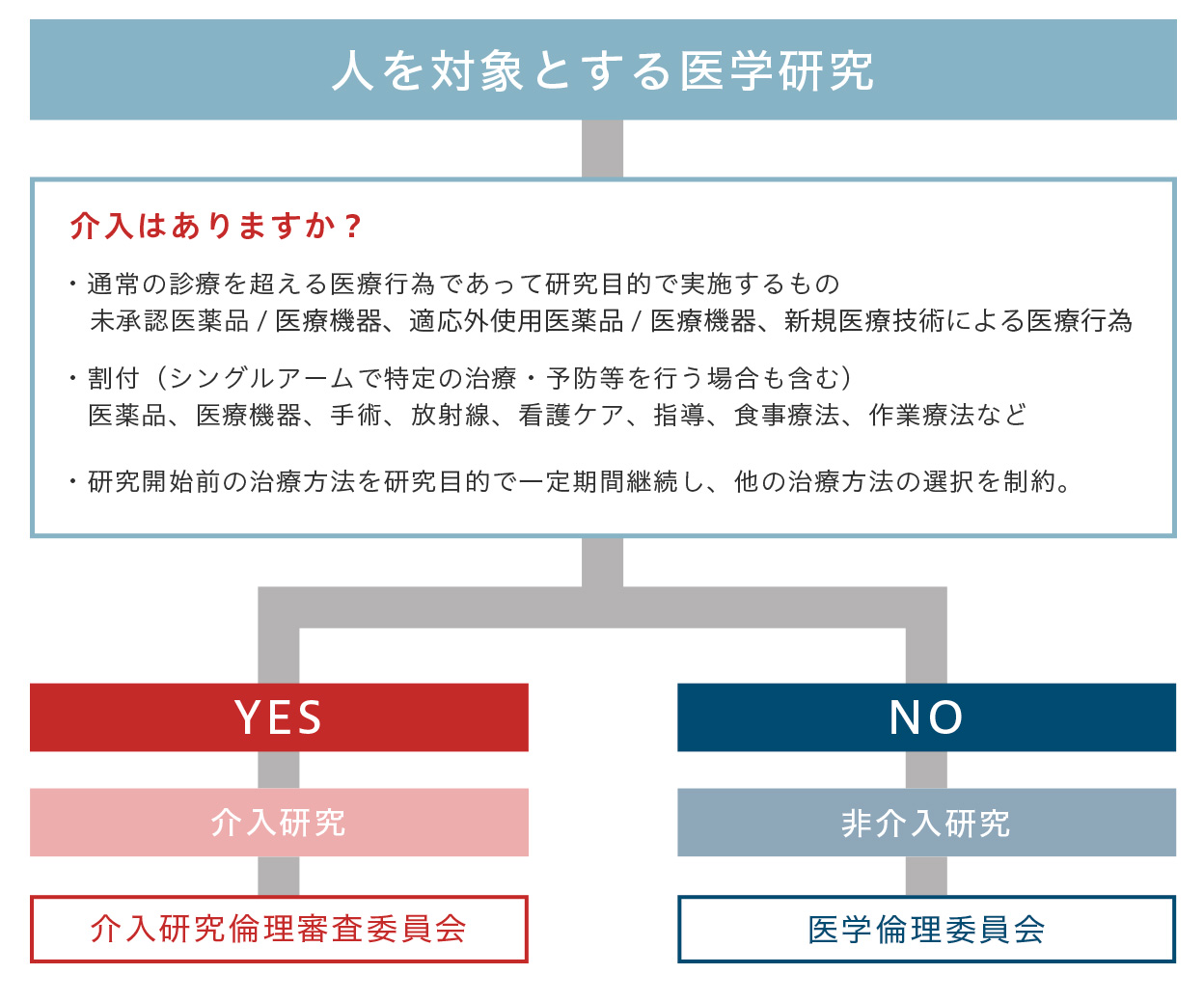
研究分類別:倫理審査について
介入の有無により審査される倫理審査委員会が異なります。
必要な書類と手続き
必要な書類が異なりますのでご注意ください。
表1:手続き書類
| 提出資料/研究タイプ | 介入研究 | 非介入研究 (生体試料あり) |
非介入研究 (生体試料なし) |
|---|---|---|---|
| 審査依頼書 | 必要 | 必要 | 必要 |
| 臨床研究分担者リスト | 必要 (多機関共同研究の場合:一括審査を希望する当院以外の研究機関分も含む) |
必要 (多機関共同研究の場合:一括審査を希望する当院以外の研究機関分も含む) |
必要 (多機関共同研究の場合:一括審査を希望する当院以外の研究機関分も含む) |
| 研究機関リスト | 必要 必要時(多機関共同研究の場合) |
必要 必要時(多機関共同研究の場合) |
必要 必要時(多機関共同研究の場合) |
| 実施研究機関要件確認書 | 必要時 (多機関共同研究の場合:一括審査を希望する当院以外の研究機関分) |
必要時 (多機関共同研究の場合:一括審査を希望する当院以外の研究機関分) |
必要時 (多機関共同研究の場合:一括審査を希望する当院以外の研究機関分) |
| 教育受講歴確認書 | 必要時 (多機関共同研究の場合:一括審査を希望する当院以外の研究機関分) |
必要時 (多機関共同研究の場合:一括審査を希望する当院以外の研究機関分) |
必要時 (多機関共同研究の場合:一括審査を希望する当院以外の研究機関分) |
| 倫理審査結果通知書の写し | 必要時 | 必要時 | 必要時 |
| 臨床研究実施計画書 | 必要 | 必要 | 必要 |
| 臨床研究実施計画書(別紙) | 必要時 | 必要時 | 必要時 |
| 同意説明文書 | 必要 | 必要 | 必要時 |
| アセント文書 | 必要時 | 必要時 | 必要時 |
| 情報公開文書 | 必要時 | 必要時 | 必要時 |
| 配布物(日誌、QOL調査票、アンケート等) | 必要時 | 必要時 | 必要時 |
| 試験薬等の概要書(添付文書等) | 必要時 | 必要時 | 必要時 |
| 被験者募集ポスター | 必要時 | 必要時 | 必要時 |
| 症例報告書の見本 | 必要時 | 必要 | 必要 |
| 臨床研究保険(見積書) | 必要時 | 任意 | 任意 |
| モニタリング・監査手順書 | 必要時 | 必要時 | 必要時 |
| 利益相反マネジメント自己申告書 | 必要 | 必要 | 必要 |
表2:既存試料・情報を提供・利用する際の同意手続き
| 既存試料・情報の種類 | 自機関で利用 | 他機関への提供 (提供する側) |
他機関からの取得 (提供される側) |
|---|---|---|---|
| 匿名化なし・人体取得試料 |
・文書同意によらない場合は口頭同意 ・文書同意、口頭同意が困難な場合はオプトアウト ※いずれも困難な場合の例外あり |
・文書同意によらない場合は口頭同意 ・文書同意、口頭同意が困難な場合はオプトアウト ※いずれも困難な場合の例外あり |
・文書同意、口頭同意が困難な場合はオプトアウト ※いずれも困難な場合の例外あり |
| 匿名化なし・人体取得試料以外 | 文書同意、口頭同意が困難な場合はオプトアウト | ||
| 匿名化されている | 手続き不要 | ||