認定臨床研究審査委員会について
About CRB
- TOP
- 定期報告について
About KOBE Univ. Hosp. CRB
定期報告提出書類について
定期報告に必要な書類
-
定期報告書【統一書式5】
※または、臨床研究申請システムの申請画面からフォーム入力でもご作成いただけます。 - 定期報告書【別紙様式3】
※jRCT(厚生労働省の整備するデータベース)にアクセスし、必要事項を入力してご作成ください。
※非特定臨床研究については不要です。
※まだjRCT上の申請は行わず、「一時保存」をクリックしてください。ログイン後トップ画面の「届出書出力」をクリックすることで作成した「別紙様式3」のPDFをダウンロードできますので、そちらをご提出ください。 - 利益相反管理基準【様式A】
※変更がある場合 - 利益相反管理計画【様式E】
※変更がある場合 - モニタリング報告書(定期報告対象期間中に実施したもの)
- その他提出を求められたもの
定期報告書:研究実施中の定期報告
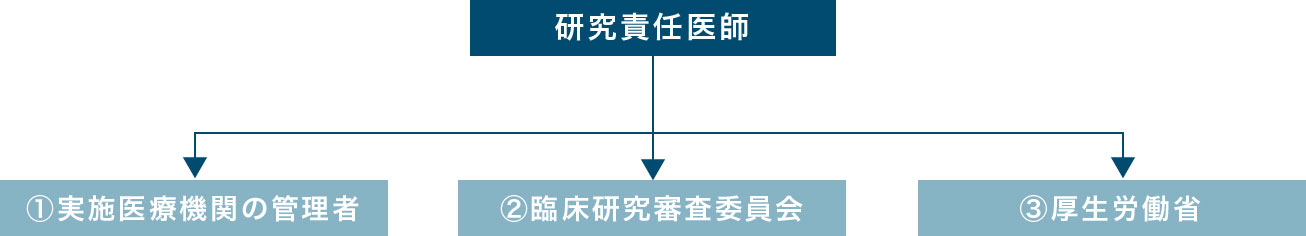
研究責任医師(多施設の場合は研究代表医師)は、臨床研究の実施状況・疾病等の発生状況について、実施計画を厚生労働大臣に提出した日から1年毎に報告しなければならないと定められています。(例:2018年6月から研究を開始した場合は、2019年の8月までに2018年6月~2019年5月の報告を行なう)
①実施医療機関の管理者に報告したうえで、②認定臨床研究審査委員会へ報告し、認定臨床研究審査委員会が意見を述べた日から起算して1ヵ月以内に③厚生労働大臣への報告を行なうことが義務付けられています。
①実施医療機関の管理者への定期報告
②認定臨床研究審査委員会への定期報告事項
②認定臨床研究審査委員会への定期報告事項
- 【報告事項】
- ・臨床研究に参加した対象者の数
- ・臨床研究に係る疾病等の発生状況及びその後の経過
- ・省令又は研究計画書に対する不適合の発生状況及びその後の対応
- ・安全性及び科学的妥当性についての評価
- ・管理が必要な利益相反の関与に関する事項
- 【報告時期】
- 実施計画を厚生労働大臣に提出した日から起算して1年ごとに、当該期間満了後2ヵ月以内
- 【報告事項】
- ・実施計画に記載されている認定臨床研究審査委員会の名称
- ・当該委員会による研究継続の適否
- ・臨床研究に参加した対象者の数
- 【報告時期】
- 認定臨床研究審査委員会が意見を述べた日から起算して1ヵ月以内