治験依頼者の方へ
For Client
KOBE Univ. Hosp. CTRC for Client
調査における各種手続き・様式集
調査新規申請
製造販売後調査は、当院で採用されている医薬品及び医療機器が対象です。
採用前には申請を受理いたしかねますので、採用後にご申請ください。
委員会開催日程・申請締切日は
こちらを確認してください。
迅速審査の対象となる調査は、随時受付けております。
新規申請の流れ
以下のフロー図に従って申請してください。
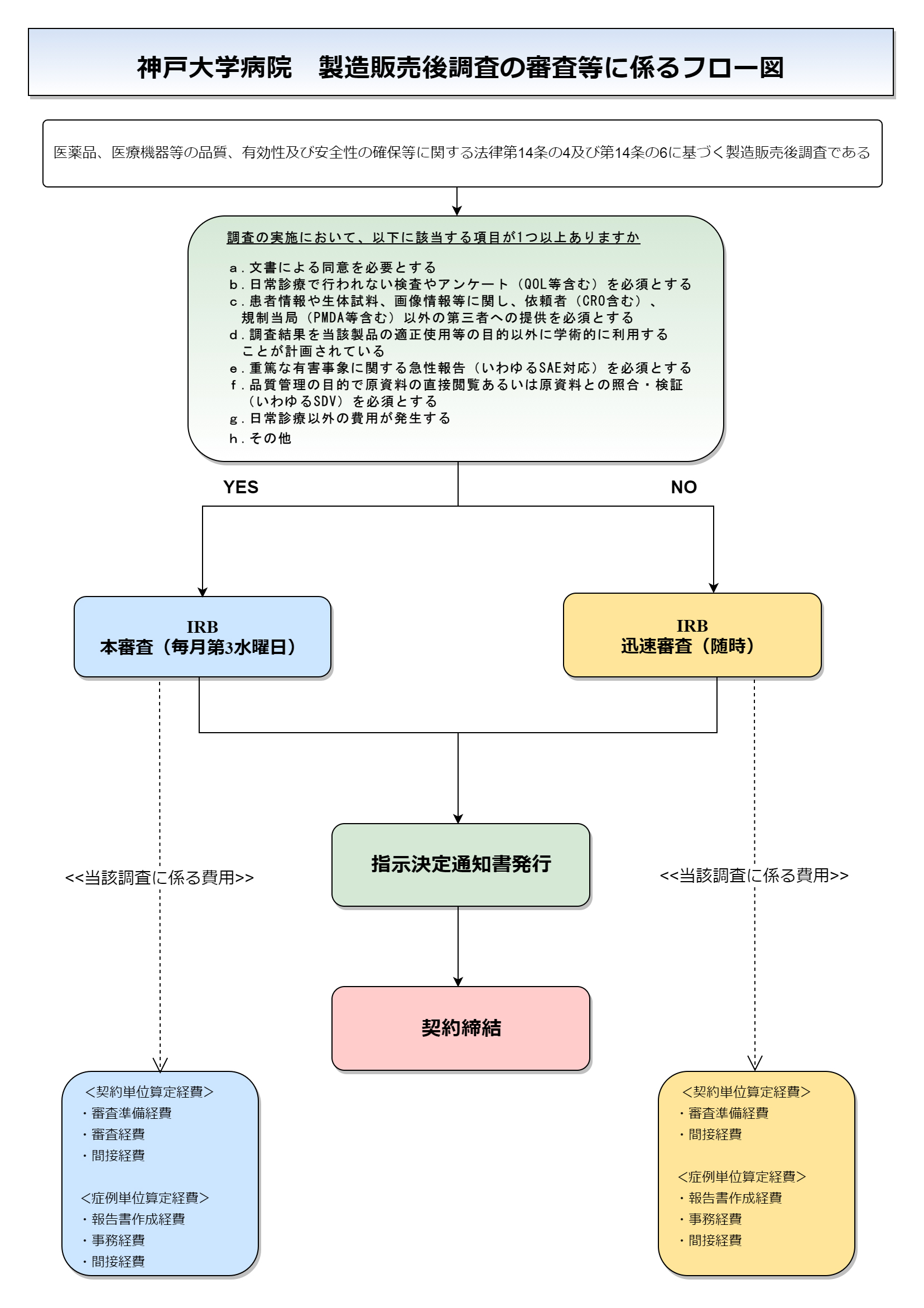
申請関連窓口 IRB事務局
(研究棟A 6F) こちら宛
以下の書類をIRB 5週間前までに提出
迅速審査の場合は「2.本申請について」へお進みください
内容確認後、ご連絡
本審査の場合:以下の書類をIRB 2週間前までに提出
迅速審査の場合:以下の書類を速やかに提出
■申請書類・・・各1部
①様式1(押印済)
②様式2
③様式3
■審議資料
本審査の場合:最終確定版審議ファイル・・・20部
迅速審査の場合:最終確定版審議ファイル・・・1部
審議(本審査・迅速審査共通)
承認
経費・契約関連窓口 臨床研究推進センター
(研究棟A 6F) こちら宛
以下の書類をIRB 4週間前までにメールにて送付
迅速審査の場合は「2.本申請について」へお進みください
■経費・契約関連の書類
⑦契約書式3
⑧契約書式5
※原契約の読み替えや追記事項がある場合のみ作成
⑨経費書式13および経費書式14-1
⑩依頼者担当者連絡表
内容確認後、ご連絡
本審査の場合:以下の書類をIRB 1週間前までに提出
迅速審査の場合:以下の書類を速やかに提出
■経費・契約関連の書類
⑦契約書式3・・・押印済2部
⑧契約書式5・・・押印済2部
⑨経費書式13および経費書式14-1
⑩依頼者担当者連絡表
新規申請に必要な書類
申請書類について
提出前に電子ファイルにてプレチェックを行っています。
まずは下記書類をIRB事務局 こちら宛にご送付ください。
必ず件名に「新規申請調査」と入れてお送りください。
- ① 製造販売後調査依頼書 様式1
- ② 製造販売後調査審査依頼書 様式2
- ③ 製造販売後調査結果通知書 様式3
- ④ 事務上の確認事項 書式
- ⑤ 調査実施要綱
- (⑥ 同意説明文書)書式※再審査・再評価以外の調査については同意説明文書が必要です。
医師控、患者控、臨床研究推進センター控と印字の上、3部複写
審議資料について
仮申請及び本申請にご提出いただく審議ファイルの内訳は以下の通りです。
審議ファイル内訳
- 1. 調査実施要綱
- 2. 登録票・調査票
- 3. 添付文書
- 4. インタビューフォーム又は医薬品概要書
- (5. 同意説明文書)※必要時提出
- 6. 製造販売後調査経費算定書(経費書式13および経費書式14-1)
- (7. 治験審査委員会が必要と認める資料)※必要時提出
資料のファイリング
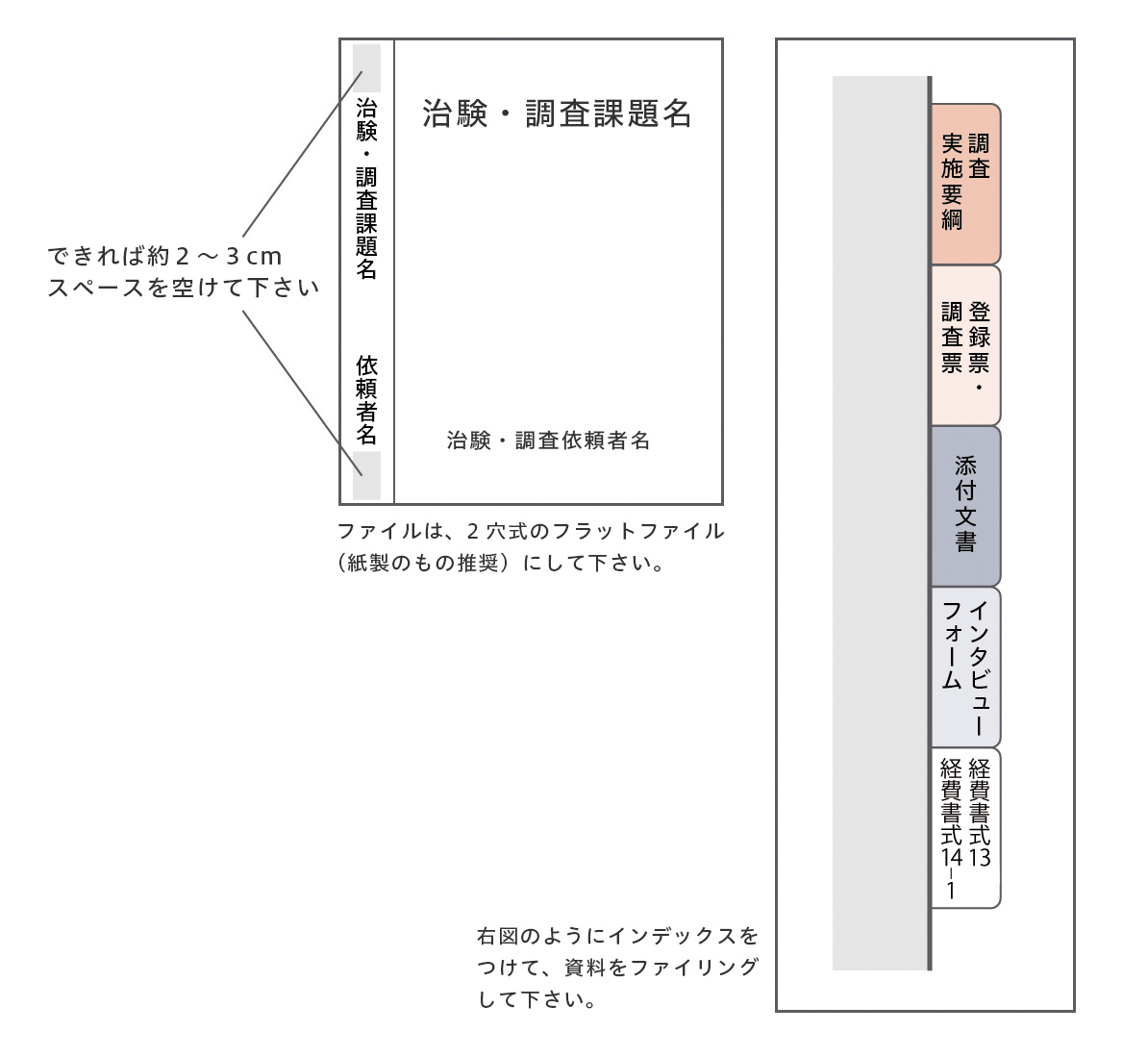
経費・契約関連の書類について
提出前に電子ファイルにてプレチェックを行っています。
まずは下記書類を契約担当者 こちら宛にご送付ください。
必ず件名に「新規申請調査」と入れてお送りください。
算定要領は、こちらを確認してください。
- ⑦ 製造販売後調査等契約書 契約書式3
- ⑧ 覚書(製造販売後調査) 契約書式5
- ⑨ 経費書式13および経費書式14-1 経費書式13
- ⑩ 依頼者担当者連絡表 書式
※原契約の読み替えや追記事項がある場合のみ作成
調査変更申請
以下の場合、変更申請が必要です。
迅速審査の対象(例)
- 予定症例数の追加
- 調査期間の延長(1年まで)
- 調査分担医師の追加・削除
等
IRB本審査の対象(例)
- 調査責任医師の変更
- 調査期間の延長(1年を超える場合)
- 実施要綱の改訂
等
変更申請の流れ
申請関連窓口 IRB事務局
(研究棟A 6F) こちら宛
メールにて送付
■申請書類
①様式5
②様式2
③様式3
実施要綱改訂の際は、以下書類についても
ご提出ください。
・改訂版の実施要綱
・変更対比表
内容確認後、ご連絡
■申請書類・・・各1部
①様式5
②様式2
③様式3
実施要綱改訂の際は、以下書類についても
ご提出ください。
・改訂版の実施要綱
・変更対比表
迅速審査(随時)または
IRB本審査にて審議
承認
経費・契約関連窓口 臨床研究推進センター
(研究棟A 6F) こちら宛
変更内容が以下の場合、変更契約書もご提出ください。
・予定症例数の追加
・調査期間の延長
・責任医師の変更
メールにて送付
■契約関連の書類
④契約書式8
内容確認後、ご連絡
■経費・契約関連の書類
④契約書式8・・・押印済2部
変更申請に必要な書類
申請書類について
提出前に電子ファイルにてプレチェックを行っています。
まずは下記書類をIRB事務局 こちら宛にご送付ください。
必ず件名に「変更申請調査 00000(当事務局から付与された整理番号)」と入れてお送りください。
※実施要綱改訂の際は、以下の書類についてもご提出ください。
- ・改訂版の実施要綱
- ・変更対比表
経費・契約関連の書類について
提出前に電子ファイルにてプレチェックを行っています。
まずは下記書類を契約担当者 こちら宛にご送付ください。
必ず件名に「変更申請調査 00000(当事務局から付与された整理番号)」と入れてお送りください。
算定要領は、こちらを確認してください。
- ④ 変更契約書(製造販売後調査) 契約書式8
病院長報告(軽微な変更)について
以下の場合、変更申請は不要です。
病院長報告のみの対象となる変更
- 依頼者の組織・体制の変更
- 同意説明文書の軽微な誤植
上記以外の軽微な変更についてはご相談ください。
提出形態
書類の形式は問いませんが、下記参照のうえ提出してください。
- 神戸大学医学部附属病院 病院長宛であること
- 変更内容を前後対比表に記載すること
調査 副作用・感染症報告申請
副作用・感染症報告申請に必要な書類・資料
申請書類について
①医薬品の副作用・感染症報告書を薬剤部 薬品情報室(DI室)までご提出ください。
【問い合わせ先・申請書類】薬剤部 薬品情報室(DI室)まで
※担当医師の捺印取得は依頼者さまにお願いしています。
経費・契約関連の書類について
②~④までの書類を臨床研究推進センター(研究棟A 6F)までご提出ください。
調査 終了(中止)報告
調査終了(中止)報告は全ての調査票の回収が完了した後にご提出ください。
終了(中止)報告に必要な書類
申請書類について
提出前に電子ファイルにてプレチェックを行っています。
まずは下記書類をIRB事務局 こちら宛にご送付ください。
必ず件名に「終了報告調査 00000(当事務局から付与された整理番号)」と入れてお送りください。
- ① 製造販売後調査終了(中止)報告書 様式7
※責任医師の捺印取得については依頼者様にお願いしています。
・必ず契約期間内に提出してください。月末締め、翌月IRB報告です。
・調査票の回収が契約期間を超える場合は、変更申請にて期間延長の手続きをお願いします。
調査修正
審査結果が「修正の上で承認」となった場合には、以下の修正報告書を提出してください。
修正に必要な書類・資料
申請書類について
提出前に電子ファイルにてプレチェックを行っています。
まずは下記書類をIRB事務局 こちら宛にご送付ください。
必ず件名に「調査修正報告 00000(当事務局から付与された整理番号)」と入れてお送りください。
- ① 製造販売後調査実施要綱等修正報告書 様式4
- ② その他必要書類
指示事項にあるもの
調査・継続審査
2025年度 調査・継続審査
現在実施中の製造販売後調査について同意取得が規定されている場合は、継続審査が必要です。但し、以下のものを除きます。
・2025年度中(2026年3月31日まで)に終了報告をされるもの。
・2026年1月のIRBに新規申請されるもの。
継続審査が必要な調査について、以下の必要書類をご提出ください。
申請書類について
提出前に電子ファイルにてプレチェックを行っています。
まずは下記書類をIRB事務局 こちら宛にご送付ください。
必ず件名に「***年度(該当年度) 調査・継続審査 00000(当事務局から付与された整理番号)」と入れてお送りください。
ドラフト提出期限…2025年12月10日(水)必着
(※上記期日を過ぎる場合は、事務局までご連絡ください。)
変更事項がある場合は、IRB事務局までご連絡ください。
経費・契約関連の書類について
症例追加、契約期間延長等については、調査変更申請をご確認のうえ、変更契約書 契約書式8を契約担当者 こちら宛にご送付ください。
また、新たに調査票が作成された場合は、経費書式14-1または経費書式14-2をご送付ください。