認定臨床研究審査委員会について
About CRB
- TOP
- 疾病・不具合報告について
About KOBE Univ. Hosp. CRB
疾病・不具合報告について
疾病・不具合報告書類について 疾病・不具合報告について 疾病・不具合に係る定期報告
疾病・不具合報告に必要な書類
■医薬品疾病等報告
-
医薬品疾病等報告書【統一書式8】
※または、臨床研究申請システムの申請画面からフォーム入力でもご作成いただけます。 - 詳細記載用書式
■医療機器疾病等又は不具合報告
-
医療機器疾病等又は不具合報告書【統一書式9】
※または、臨床研究申請システムの申請画面からフォーム入力でもご作成いただけます。 - 詳細記載用書式
■再生医療等製品疾病等又は不具合報告
-
再生医療等製品疾病等又は不具合報告書【統一書式10】
※または、臨床研究申請システムの申請画面からフォーム入力でもご作成いただけます。 - 詳細記載用書式
疾病・不具合報告について
特定臨床研究の実施中に、下記の表に示す疾病・不具合が発生した際には実施医療機関の管理者および認定臨床研究審査委員会に報告することが、研究責任医師に義務付けられています。
報告の対象となるのは、特定臨床研究の実施によると疑われる疾病・不具合です。
7日、15日、30日を期限とする報告が遅れた場合、理由書の記載等が求められる可能性があります。
厚生労働大臣への報告は、 jRCT にアクセスし、システム上で報告様式を作成して行います。
※臨床研究法下に必要な手続きは、下記をご確認ください。
医薬品の特定臨床研究
| 研究の区分 | 予測可能性 | 重篤性 | 期限 | 施行規則 |
|---|---|---|---|---|
| 未承認又は適応外の医薬品等を用いる研究 | 予測できない |
|
7日 | 第五十四条一号 |
| 予測できる |
|
15日 | 第五十四条二号イ | |
| 予測できない |
|
15日 | 第五十四条二号ロ | |
| 既に承認されている医薬品等を用いる研究(未承認又は適応外の医薬品等を用いる研究以外) | 問わない | ・死亡(※感染症を除く) | 15日 | 第五十四条三号イ |
|
|
15日 | 第五十四条三号ロ | |
| 予測できる | 30日 | 第五十四条四号 | ||
| 予測できない | ・感染症による疾病等 | 15日 | 第五十四条三号ハ | |
| 問わない |
|
15日 | 第五十四条三号ニ |
医療機器・再生医療等製品の特定臨床研究
| 研究の区分 | 予測可能性 | 重篤性 | 期限 | 施行規則 |
|---|---|---|---|---|
| 医療機器又は再生医療等製品を用いる研究 | 予測できない |
|
30日 | 第五十五条 |
| 予測できる |
多施設共同研究における疾病等報告のフロー(施行規則第五十四~五十六条)
例:A病院で、特定臨床研究による疾病等が発生した場合
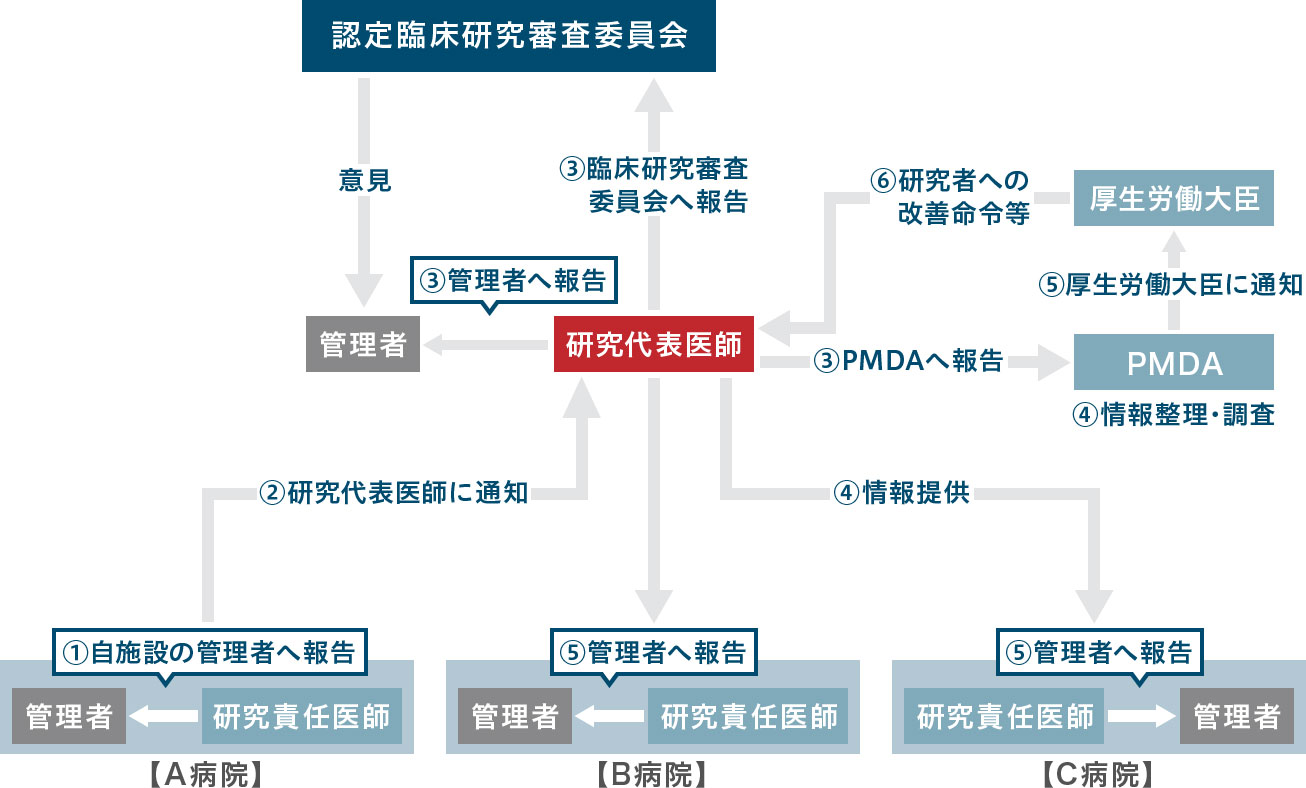
疾病・不具合に係る定期報告
特定臨床研究の実施に起因すると疑われる疾病等のうち、上記の表に該当しない疾病等については、認定臨床研究審査委員会への定期報告時に報告することが定められています。
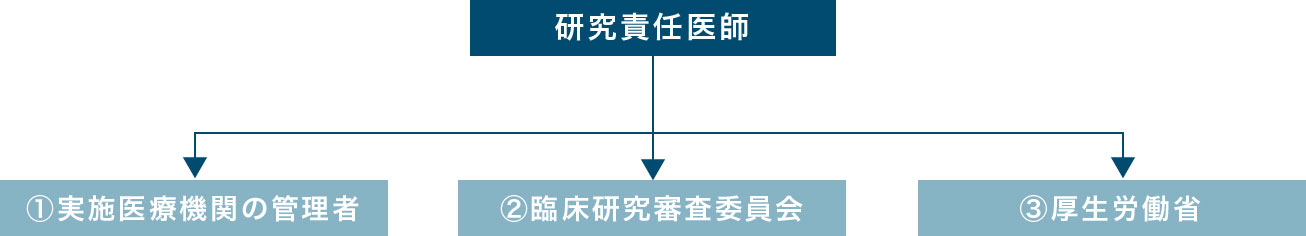
研究責任医師(多施設共同研究の場合は研究代表医師)は、特定臨床研究の実施状況について年に1回以上、①実施医療機関の管理者に報告した上で、②認定臨床研究審査委員会へ報告することが定められています。
さらに認定臨床研究審査委員会が意見を述べた日から起算して1か月以内に③厚生労働大臣への報告を行なうことが義務付けられています。
②認定臨床研究審査委員会への定期報告事項
- 【報告事項】
- ・臨床研究に参加した対象者の数
- ・臨床研究に係る疾病等の発生状況及びその後の経過
- ・省令又は研究計画書に対する不適合の発生状況及びその後の対応
- ・安全性及び科学的妥当性についての評価
- ・管理が必要な利益相反の関与に関する事項
- 【報告時期】
- 実施計画を厚生労働大臣に提出した日から起算して1年ごとに、当該期間満了後2ヵ月以内
- 【報告時期】
- ・実施計画に記載されている認定臨床研究審査委員会の名称
- ・当該委員会による研究継続の適否
- ・臨床研究に参加した対象者の数
- 【報告時期】
- 認定臨床研究審査委員会が意見を述べた日から起算して1ヵ月以内